
Was macht das Gehirn krank?
Forschende der Hochschule für Life Sciences FHNW lassen gentechnisch veränderte Nervenzellen an Alzheimer erkranken. Damit wollen sie nach einem Heilmittel gegen die Demenzerkrankung suchen.
Alzheimer ist eine der rätselhaftesten
Erkrankungen des Gehirns. Weltweit leiden rund 50 Millionen Menschen
daran und bislang gibt es keine Heilung. Wie genau die Krankheit
entsteht und was sie mit den Neuronen macht, ist nicht genau bekannt.
Die Zellbiologin Laura Suter-Dick von der Hochschule für Life Sciences FHNW
will dies ändern. Ihrem Team ist es gelungen, menschliche Neuronen in
Petrischalen mit Alzheimer zu infizieren. «Damit haben wir nun ein
Werkzeug, mit dem wir die Mechanismen der Krankheit entschlüsseln
können», sagt Suter-Dick.
Bis heute weiss man lediglich, dass in
manchen Fällen mutierte Gene für eine Erkrankung verantwortlich sind.
Drei dieser Gene sind bis heute bekannt. Durch sie kann Alzheimer von
Eltern auch an ihre Kinder weitergegeben werden, was zu familiären
Häufungen führt.
Diese defekten Gene fügten Suter-Dick und ihre
Kolleginnen und Kollegen via Gentechnik in gesunde menschliche Neuronen
ein. «Dazu haben wir das fehlerhafte Erbgut in Viren verpackt», sagt die
Neurobiologin Carine Gaiser vom Institut für Chemie und Bioanalytik der
Hochschule für Life Sciences FHNW. «Die Viren befallen die gesunden
Nervenzellen und übertragen die neuen Gene auf sie. Dann bauen die
Zellen diese Gene in ihr eigenes Erbgut ein und werden dadurch krank.»
Nervenzellen beim Zerfall beobachten
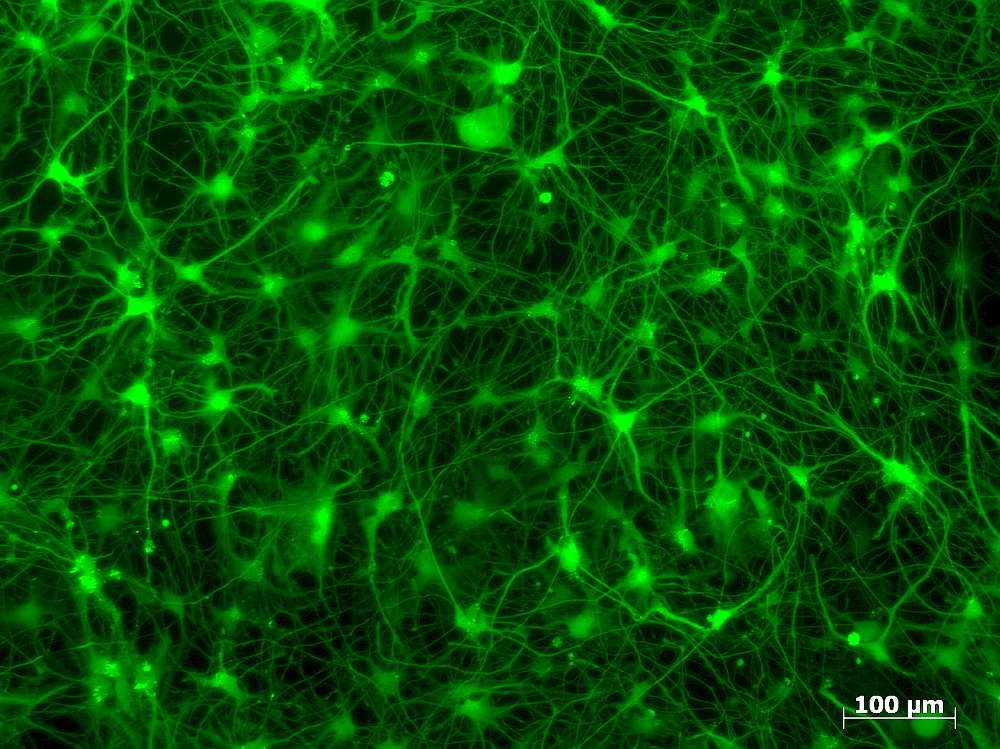
Die so veränderten Nervenzellen lassen sich in Zuchtschalen mehrere Monate halten und vermehren. Damit die anschliessenden Experimente möglichst realistisch ausfallen, haben die Forschenden die Neuronen in eine dreidimensionale Matrix aus Gelatine eingebaut. Dadurch werden die Zellen wie Fruchtstückchen in einem Wackelpudding fixiert. Das hat den Vorteil, dass sich die Neuronen zu einem Netzwerk zusammenschliessen können, indem sie sogenannte Dendriten und Axonen ausbilden. Das sind die Verbindungskabel, mit denen Neuronen elektrische Signale weiterleiten. «Nach einigen Tagen entsteht ein winziges Abbild des neuronalen Netzwerks des Gehirns», erklärt Suter-Dick.
An diesem «Minigehirn» lässt sich dann das Fortschreiten der Krankheit mit dem Mikroskop verfolgen. Dies war bisher nicht möglich, denn bei Patientinnen und Patienten liegen die kranken Neuronen tief im Gehirn verborgen und sind damit praktisch unzugänglich. «Wir können einem Patienten ja nicht einfach ein Loch in den Kopf bohren und hineingucken», sagt Suter-Dick. Als Ausweg griff die Forschung bislang auf Tierversuche zurück. Die von Suter-Dick neu entwickelten Zellkulturen könnten solche Tierversuche künftig überflüssig machen.
Ein weiterer grosser Vorteil der Petrischalen-Neuronen ist, dass die Krankheit quasi im Zeitraffer fortschreitet, bis die Zellen schliesslich absterben. Im menschlichen Gehirn wird die Krankheit immer wieder kompensiert, was dazu führt, dass sich der Zerfall der Neuronen über Jahre oder gar Jahrzehnte hinzieht. In den Petrischalen, wo alle Zellen gleich krank sind, läuft der ganze Zyklus innert Wochen ab. «Dadurch können wir Alzheimer bei der Zerstörung der Neuronen zuschauen», sagt Suter-Dick.

Verschiedene Phasen der Krankheit
Eines der grossen Rätsel ist, wie die einzelnen Phasen der Krankheit kausal miteinander zusammenhängen. Beispielsweise scheiden erkrankte Neuronen sogenannte Beta-Amyloid-Proteine aus, die sich ausserhalb der Zellen als Ablagerungen anreichern – die sogenannten Plaques. In einem gesunden Gehirn könnten diese Ablagerungen sofort wieder abgebaut werden. Doch bei Alzheimer-Patienten bleiben sie liegen. Ob dies nun eine reine Folge der Erkrankung ist oder ob die Proteinhaufen deren Ursache oder ein Beschleuniger für den weiteren Zerfall der Zellen sind, ist bislang unklar.
Ebenso kann die Wissenschaft bis heute nicht genau erklären, was sich in den Zellen abspielt. Dort verhält sich ein zweites Protein komplett verrückt. Das sogenannte Tauprotein ist ein wichtiger Baustoff von Nervenzellen. Aus ihm bestehen beispielsweise die Kanäle in den Zellwänden, durch welche die Nährstoffversorgung stattfindet. Doch unter Alzheimer schliessen sich diese Proteine zu Fasern zusammen, welche die Zelle verstopfen. In der Folge kann sie sich nicht mehr mit Nährstoffen versorgen und stirbt ab. Auch hier ist nicht klar, was Ursache und was Folge ist.
Fakt ist, dass die meisten Alzheimerpatienten und -patientinnen gesunde Gene haben, ihre Neuronen jedoch trotzdem Ablagerungen und Fasern produzieren. «Es müssen also noch andere Faktoren eine Rolle spielen», sagt der Molekularbiologe Eric Kübler vom Institut für Chemie und Bioanalytik der Hochschule für Life Sciences FHNW. «Die Story ist grösser, als man bis jetzt gedacht hat. Alzheimer ist immer noch ein riesiges Rätsel», sagt er.
Mit ihren neuen Zellkulturen können die Forschenden gleich auf mehreren Ebenen ansetzen. «Wir arbeiten mit einem Industriepartner zusammen, der neue Wirkstoffe an den Kulturen testen möchte», sagt Suter-Dick. «Hier im Labor werden wir uns darauf konzentrieren, die Krankheit zu verstehen. Mit diesem Wissen könnten wir dereinst zuverlässige Diagnosen beispielsweise via Bluttest entwickeln. Damit könnte man die Krankheit frühzeitig erkennen und lindernde Gegenmassnahmen einleiten.»
Härtefall Alzheimer
Für Pharmaunternehmen stellt sich Alzheimer als Knacknuss heraus. Bereits über hundert klinische Studien wurden durchgeführt, die jedoch allesamt keinen Erfolg brachten. Grosse Firmen wie Roche, Johnson & Johnson oder Merck haben sich bereits die Zähne ausgebissen. Und die Liste wird stetig länger. Pfizer stellte 2018 die Arbeit an der Entwicklung von Medikamenten gegen Alzheimer ein. Und im März dieses Jahres gab auch der internationale Biotechnologiekonzern Biogen bekannt, dass er die Tests an einem bislang vielversprechenden Wirkstoff einstellen werde.

